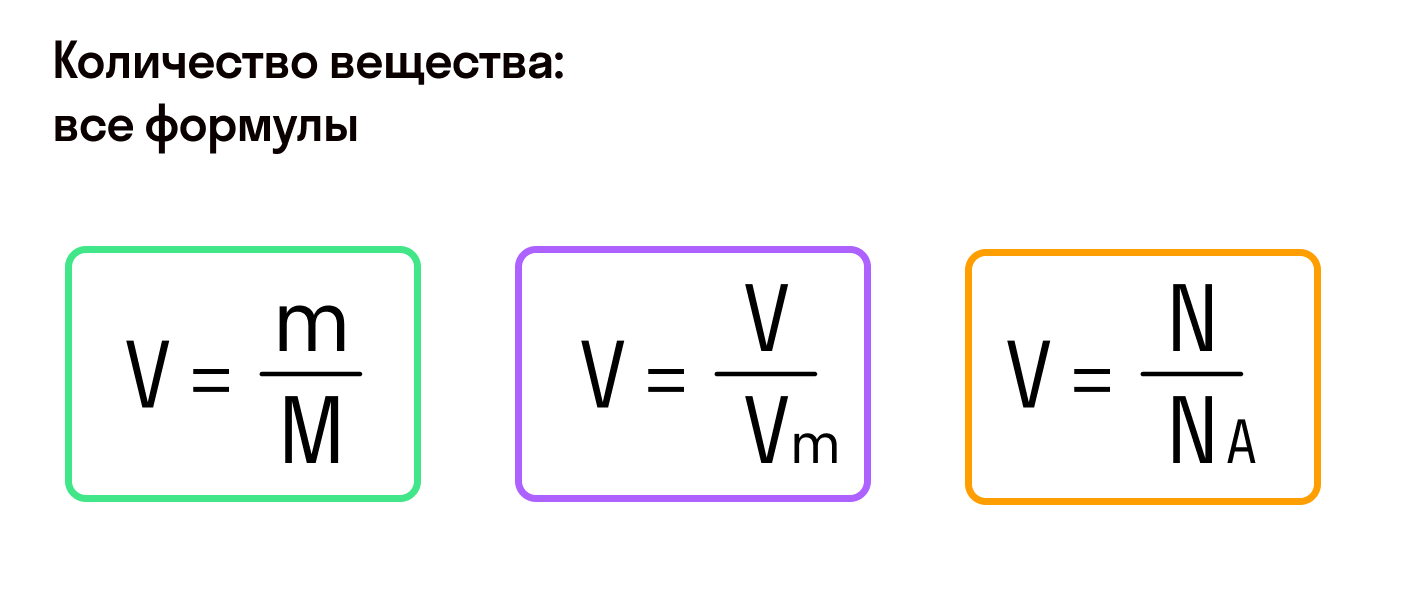
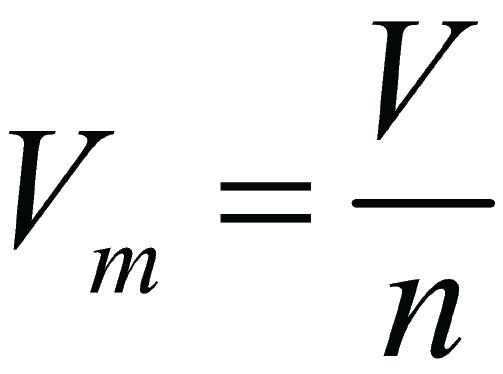Число авогадро это отношение

Число Авогадро
В виде гипотезы был сформулирован в году Амедео Авогадро , профессором физики в Турине. Гипотеза была подтверждена многочисленными экспериментальными исследованиями и поэтому стала называться законом Авогадро , став впоследствии через 50 лет, после съезда химиков в Карлсруэ количественной основой современной химии стехиометрии [1]. Закон Авогадро точно выполняется для идеального газа , а для реальных газов он является тем более точным, чем газ более разреженный. Первые количественные исследования реакций между газами принадлежат французскому ученому Гей-Люссаку. Он является автором законов о тепловом расширении газов и закона объемных отношений.








Из Википедии:. Число Авогадро, константа Авогадро, постоянная Авогадро — физическая величина, численно равная количеству специфицированных структурных единиц атомов, молекул, ионов, электронов или любых других частиц в 1 моле вещества. Ранее определялось как количество атомов в 12 граммах точно чистого изотопа углерода Обозначается обычно как NA, а иногда и L.










Коллектив ученых из Германии, Италии, Франции и Японии получил самое точное на сегодняшний день значение числа Авогадро , которое определяет, сколько атомов, молекул или других частиц содержится в единице количества вещества — одном моле. Новое исследование является частью проекта, в рамках которого планируется переопределить понятие килограмма в терминах фундаментальных физических констант. Авторы создали статистическую модель, позволившую им усреднить значения числа Авогадро, полученные немногим ранее в году и до этого в году. В указанных экспериментах проводили измерения эталонных сфер, выточенных из монокристалла сверхчистого кремния Si